Korozní zkoušení kovových materiálů

2 Korozní vlastnosti materiálů
Pojem koroze kovů lze charakterizovat jako samovolné, postupné a nevratné znehodnocování materiálů a to chemickým nebo fyzikálně chemickým působením okolního prostředí za určité teploty a tlaku. Může probíhat v atmosféře nebo jiných plynech, ve vodě a jiných kapalinách, zeminách a různých chemických látkách, které jsou s materiálem ve styku. Toto rozrušování se může projevovat rozdílně; od změny vzhledu až po úplný rozpad celistvosti.
Dle podstaty lze korozi rozdělit na dva základní druhy:
- chemická,
- elektrochemická.
2.1 Chemická koroze
Chemická koroze probíhá v nevodivém prostředí a jedná se o samovolnou interakci kovu s korozním prostředím, při které oxidace kovu a redukce oxidující složky probíhají současně. Její základní příčinou je termodynamická nestálost kovů v různých prostředích, spojená s přechodem kovu do stálejšího stavu zplodin koroze. Samovolný proces koroze bude probíhat za podmínky, že ΔGT < 0. V opačném případě, tedy při ΔGT > 0 je proces nemožný.
Nejvíce rozšířená je chemická koroze kovů v plynech za vyšších teplot. K tomuto ději dochází v prostředích obsahujících kyslík, oxidy uhlíku, síry nebo i v dusíku či v halogenidech. V průběhu chemické koroze dochází k vytvoření korozních produktů přímo v místech, kde k reakci došlo. Na jejich jakosti a možnosti průniku korozního prostředí vrstvou korozních zplodin závisí jejich další růst a tím i rychlost koroze
2.2 Elektrochemická koroze
Elektrochemická koroze probíhá na rozdíl od chemické v elektricky vodivém prostředí – v elektrolytu, nejčastěji ve vodě, půdě, vlhké atmosféře atd. Korodující kov Me představuje anodu, na níž probíhá anodická reakce (oxidace), která vysílá do roztoku kladně nabité kationty Mez+ podle zjednodušené reakce:
Me → Mez+ + ze- (1)
Touto reakcí se v anodě hromadí elektrony, jež nemohou samy vstoupit do elektrolytu a udílejí anodě zápornější potenciál tzn., polarizují ji. Kovovým spojením tyto elektrony proudí ke katodě, kde způsobují redukci oxidačního činidla neboli depolarizátoru. Tato reakce se proto nazývá depolarizace. Obě reakce jsou na sebe vázány tím, že množství produkovaných a spotřebovaných elektronů musí být stejné, tzv. reakce „spřažené“.
Elektrický okruh je uzavřen jednak kovovým vodičem, kterým prochází elektrický proud, jednak elektrolytem, jímž jsou přiváděny ionty s elektrickým nábojem. Přerušení obvodu nebo velký odpor v něm zastaví průběh těchto reakcí. Popsanému článku velmi blízce odpovídá činnost korozního makročlánku, který se může vytvořit spojením součástí ze dvou odlišných kovů v elektrolytu obsahujícím depolarizátor.
Ve skutečných podmínkách ovšem povrch technických kovů není nikdy zcela homogenní, a proto dílčí anodická a katodická reakce probíhají alespoň s částečnou lokalizací přednostně na určitých místech povrchu.
Rychlost polarizace je vyjadřována pomocí veličiny přepětí η vzhledem k rovnováze potenciálu elektrody.
Elektrodový potenciál
Potenciál E (V) kovové elektrody v roztoku má charakter termodynamické veličiny a je závislý na změně Gibbsovy energie ΔG (J). Při reakci mezi kovem a elektrolytem dochází k výměně částic a nábojů. Za konstantního tlaku a teplotě se energie uvolňuje podle rovnice:
w = ΔG (2)
Během koroze kovu v elektricky vodivém prostředí dochází k přemísťování valenčních elektronů při průběhu příslušné elektrodové reakce:
w = zFE (3)
kde
z – počet
vyměněných elektronů v rámci jednoho atomu, F – Faradayova
konstanta
(96487 C), E – potenciál kovu [V].
Dosazením rovnice (3) do rovnice (2) dojde k vyjádření Gibbsovy energie soustavy elektrickými veličinami:
ΔG = zFE (4)
Při korozních procesech jsou nejčastějšími depolarizátory vzdušný kyslík nebo vodíkové ionty – protony. Hovoří se proto o kyslíkové či vodíkové depolarizaci.
Elektrodový potenciál má zásadní význam pro průběh elektrodové reakce. Pro každou rovnováhu elektrochemické reakce existuje její rovnovážný potenciál Er. Je-li potenciál elektrody E = Er, je reakce v rovnováze a neprobíhá. Je-li však potenciál elektrody rozdílný od rovnovážného (rovnice 4), reakce může probíhat, a to ve směru oxidace, je-li přepětí η > 0 (elektroda má kladnější potenciál než Er), nebo ve směru redukce, je-li η < 0. Přepětí současně charakterizuje hnací sílu reakce; s rostoucím η roste rychlost reakce, pokud není omezena transportními procesy.
E – Er = η ≠ 0 (5)
Kyslíková a vodíková depolarizace
Při korozních procesech jsou nejčastějšími depolarizátory vzdušný kyslík nebo vodíkové ionty – protony. Hovoří se proto o kyslíkové či vodíkové depolarizaci.
Při kyslíkové depolarizaci probíhají sumární reakce:O2 + 4H+ + 4e- → 2H2O (kyselé prostředí) (6)
O2
+ 2H2O + 4e- → 4OH-
(zásadité
prostředí)
(7)
Vzhledem k poměrně vysoce pozitivnímu potenciálu mohou s kyslíkovou depolarizací korodovat i kovy značně elektrochemicky ušlechtilé, jako cín, měď a stříbro.
Při vodíkové depolarizaci se její účinnost zvyšuje s rostoucí kyselostí roztoku a probíhají následující reakce:
2H+
+ 2e- → H2
(kyselé
prostředí)
(8)
2H2O
+ 2e- → H2
+ 2OH-
(zásadité
prostředí)
(9)
Pourbaixovy diagramy
Vliv pH na korozní
odolnost materiálů je vyjadřován v diagramech E-pH, které jsou
známé jako
Pourbaixovy diagramy. Tyto diagramy poskytují informace o reakcích a
reakčních
zplodinách po dosažení termodynamické rovnováhy v čisté vodě a
obsahují
tři základní oblasti:
- oblast imunity - samotný kov je stabilní složkou a je odolný vůči napadení v podmínkách, pro které byl diagram sestrojen,
- oblast koroze - oblast, ve které jsou splněny termodynamické podmínky pro korozi kovů a stabilními složkami jsou zde rozpustné ionty,
- pasivní oblast - termodynamicky stabilní jsou nerozpustné složky, které chrání kov před korozním napadáním.
Pourbaixův diagram pro Fe
na obr. 1 ukazuje, že
železo může korodovat
v širokém spektru pH. Při vyšších hodnotách E se vytváří pasivní
vrstva Fe2O3,
Fe3O4, resp. Fe(OH)2.
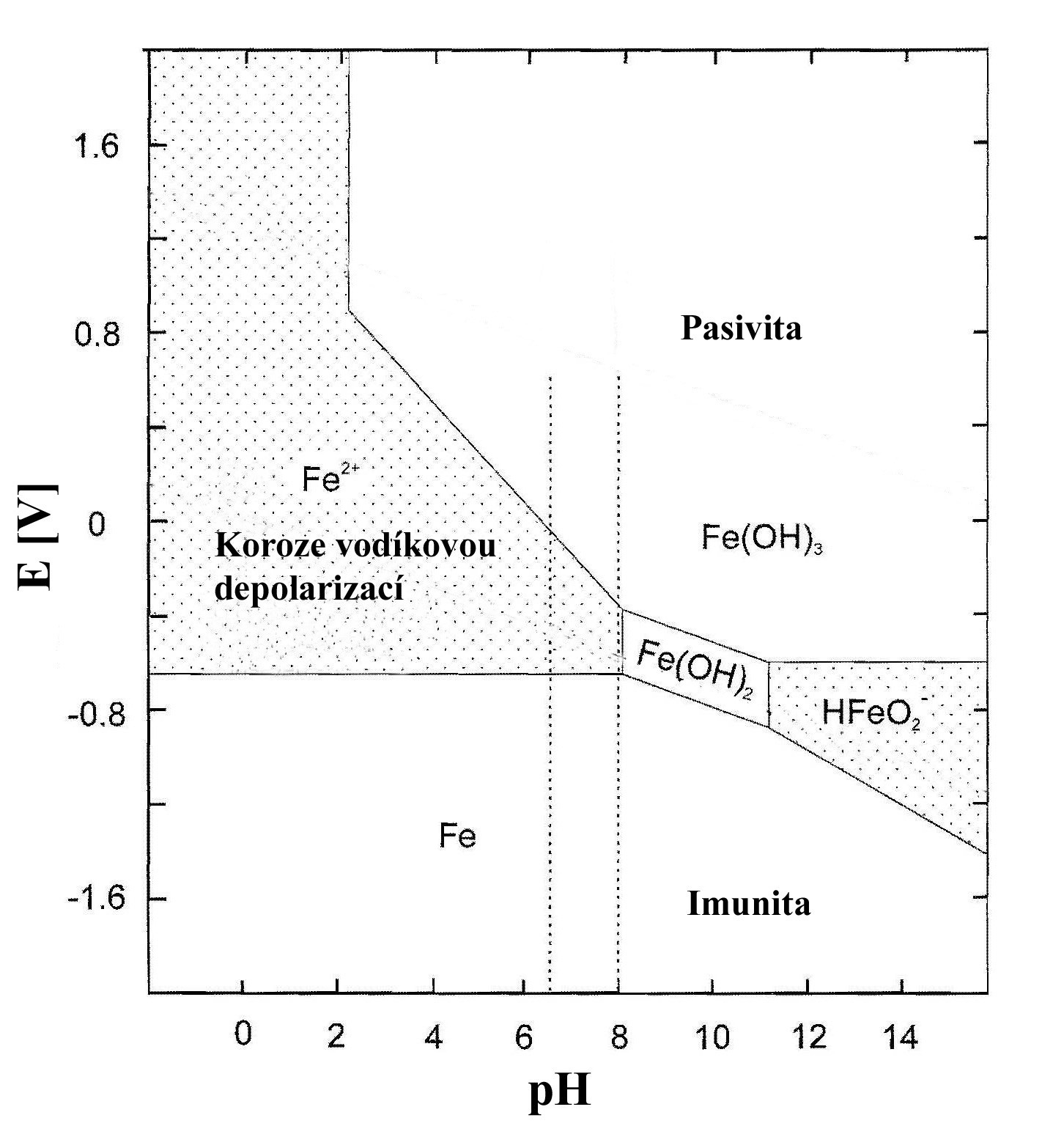
Obr. 1 Pourbaixův diagram pro Fe
Zjednodušený Pourbaixův
diagram pro Mg je
znázorněn na obr. 2. Z diagramu plyne, že při pH mezi
0 až 11 dochází k aktivnímu rozpouštění Mg, zatímco při pH větším
než 11
je chráněn stabilní pasivní vrstvou Mg(OH)2. Na rozdíl
od
hliníku vytváří hořčík stabilní pasivní vrstvy ve vodném roztoku bez
účasti
dalších iontů. Podmínkou je pouze pH vyšší než 11. Oblast imunity
existuje
kvůli výrazně negativnímu standardnímu potenciálu Mg pouze pod hodnotou
-2,5 V.
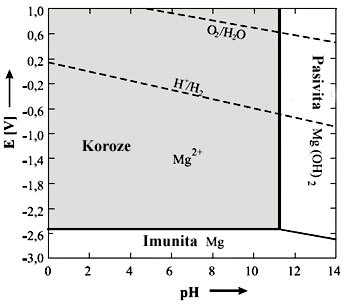
Obr. 2 Zjednodušený Pourbaixův diagram pro Mg
Z Pourbaioůva diagramu pro Cu na obr. 3 je zřejmé, že měď se dokáže pasivovat v neutrálních i ve slabě zásaditých prostředích a v kyselinách dochází ke korozi. Výrazná oblast imunity souvisí s ušlechtilostí mědi (standardní potenciál je + 0,35 V).
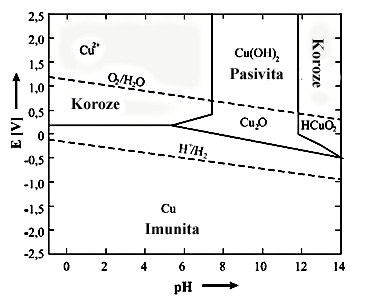
Obr. 3 Zjednodušený
Pourbaixův
diagram pro Cu
2.3 Hlavní činitelé ovlivňující korozní systém
Na vznik a na průběh korozního pochodu působí řada vlivů. Při korozním procesu se jen ve výjimečných případech uplatňuje pouze jediný vliv, i jediný působící činitel však ovlivňuje několik pochodů nebo stavů, které přímo či nepřímo souvisí s průběhem reakce kovu s prostředím. Někdy je obtížné určit, který z působících činitelů a který z jeho účinků se projeví jako rozhodující pro průběh koroze v daných podmínkách.
Vlivy působící na korozní proces lze rozdělit do tří skupin:
- dané stavem materiálu,
- dané stavem korozního prostředí,
- spojené s konstrukcí výrobku nebo zařízení.
Vliv materiálu
Údaje o korozní odolnosti materiálu se obvykle vztahují na kov nebo slitinu, které svým chemickým složením odpovídají příslušné normě nebo technickým podmínkám.
O korozní odolnosti materiálu rozhoduje:
- obsah nečistot,
- struktura materiálu,
- stav povrchu materiálu.
Nečistoty kovového materiálu mohou být dvojího druhu. Jednak je možné považovat za nečistoty všechny složky, které nejsou záměrnými legujícími přísadami (síru v oceli, železo ve slitinách hořčíku apod.). Druhým typem nečistot jsou látky, které se dostávají do povrchových vrstev při jeho zpracování nebo použití (zaválcované okuje, vměstky, méně ušlechtilé kovy atd.). Obecně lze říci, že každá nečistota může urychlit korozní pochod (např. ve slitině hliníku částice mědi vyloučené na povrchu). Nečistoty se projevují již v počáteční fázi korozního procesu, kdy mohou ovlivnit počátek celkové koroze a její charakter.
Struktura kovového materiálu je další vlastností významnou pro korozi. Pro reakci kovu s prostředím má vliv orientace jednotlivých krystalů kovu a energetické poměry v krystalové mřížce. Významným strukturním vlivem z hlediska koroze je vznik nebo změna charakteru a chemického složení fází na hranicích jednotlivých zrn. Dochází k nim při tepelném zpracování nebo již při výrobě materiálů, jejich zpracování, svařování atd. Tyto fáze mohou představovat korozně aktivnější složky nebo zhorší korozní odolnost matrice tím, že odčerpají některé prvky, např. chrom do karbidů u korozivzdorných ocelí.
Stav povrchu materiálu rovněž ovlivňuje korozní proces. Drsné povrchy snáze reagují s prostředím než hladké. Drsný povrch má celkově větší aktivní plochu a při atmosférické korozi se na drsném povrchu vytváří vrstva vlhkosti a déle se na něm udržuje než na hladkém povrchu.
Vliv korozního prostředí
Korozní systém je značně ovlivněn prostředím, ve kterém proces probíhá. Podle prostředí je možné rozlišovat:
- atmosférickou korozi,
- korozi ve vodách,
- korozi v půdách.
Atmosférická koroze se vyskytuje v největším rozsahu, neboť převážná většina kovových výrobků plní svojí funkci v atmosféře. První z vlivů, které spolupůsobí na atmosférickou korozi, jsou klimatické podmínky dané vlhkostí a teplotou vzduchu a jeho znečištěním. Tím je dán i elektrochemický charakter této koroze. Korozní děj probíhá pod velmi tenkou vrstvou vody, nasycené rozpustnými složkami atmosféry, hlavně oxidem siřičitým SO2, amoniakem NH3, kyselinou chlorovodíkovou HCl a aerosoly, příp. oxidem uhelnatým CO. Tento vodní film o tloušťce 50 až 150 μm vzniká kondenzací vodních par obsažených ve vzduchu.
Nejdůležitější jsou změny teploty související s tvorbou rosného bodu a kondenzací vodních par. Při nízkých teplotách se atmosférická koroze zastavuje zmrznutím elektrolytu. Při vzrůstající teplotě vzrůstá i rychlost koroze.
(10 – 20 %), dusík (70 – 80 %) a CO2 (0,1 –
10 %).
Korozní prostředí působí:
- chemickým složením,
- teplotou,
- tlakem,
- relativním pohybem ve vztahu k povrchu kovového materiálu.
Vyšší teplota prostředí vytváří předpoklady pro urychlení korozní reakce. Zvýšení teploty se projevuje nepříznivě hlavně u procesů s vodíkovou depolarizací a při korozi v plynech. U procesů podmíněných kyslíkovou depolarizací může mít zvýšení teploty opačný účinek.
Tlak kapalného korozního prostředí se může projevit svým mechanickým účinkem a ve spojení s korozním účinkem prostředí může urychlit některé formy strukturního napadení kovu. Významné je působení tlaku nad elektrolytem, který ovlivňuje rozpustnost plynných složek a zejména u procesů probíhajících s kyslíkovou depolarizací vede ke zvýšení koroze.
Pohyb korozního prostředí jak kapalného tak plynného je velmi častým činitelem, který se při korozi uplatňuje. Urychlení transportních pochodů, jež je s ním spojeno, vede obvykle ke zvýšení koroze. Pozitivně může působit pohyb elektrolytu, jestliže je v systému nebezpečí vzniku bodového napadení, ať je to dáno charakterem materiálu (Al s pasivní vrstvou na povrchu) nebo tím, že za klidu dochází k tvorbě usazenin na povrchu, pod nimiž může dojít k lokálnímu napadení.
Ovlivnění konstrukcí výrobku
Při praktickém použití kovových konstrukčních materiálů může někdy materiálová skladba nebo konstrukční řešení výrobku vytvořit podmínky, za nichž se chování materiálu bude lišit od případu, kdy by uvažovaným podmínkám korozního prostředí byl vystaven výrobek stejného konstrukčního materiálu.
K nejčastějším vlivům této skupiny patří:
- kontakt s jiným materiálem,
- konstrukční uspořádání některé části zařízení,
- mechanické namáhání, jakému je určitá část výrobku vystavena.
Z elektrochemické koroze plyne, že každé přímé elektricky vodivé spojení dvou kovů, které jsou ponořeny do elektrolytu, představuje potenciální korozní článek, v němž bude urychlena koroze kovu méně ušlechtilého. Škodlivý může být i kontakt kovu s nekovovým materiálem, zejména jde-li o materiál navlhavý, např. dřevo.
Podobné místně zhoršené podmínky mohou nastat i bez přítomnosti jiného materiálu jen nevhodným konstrukčním uspořádáním. Štěrbiny, rozdíly v proudění nebo teplotě média, podmínky pro tvorbu usazenin, narušování ochranných vrstev atd.
2.4 Pasivita kovů
V průběhu korozního procesu v aktivním stavu mohou vznikat korozní produkty jednoduché nebo komplexní ionty kovu rozpuštěné v korozním prostředí. V závislosti na složení kovu, prostředí a na potenciálu mohou také vznikat korozní produkty tuhé, které mohou intenzivně potlačovat průběh dílčí anodické reakce kovu, a tím učinit povrch tohoto kovu pasivním proti další korozi, tzn. povrch lze převést do pasivního stavu.
Průběh elektrochemických reakcí a popis korozních vlastností kovu nebo slitiny v široké oblasti potenciálů poskytuje potenciostatická polarizační křivka, změřená v uvažovaném korozním prostředí. Tato polarizační křivka udává informace o možnostech ochrany proti korozi v daném systému kov – elektrolyt.
Schematickou polarizační křivku znázorňuje
obr. 4.
V oblasti aktivního stavu se kov vyskytuje bez přítomnosti tuhých
korozních produktů. Po dosažení hodnoty Ep (v závěru
přechodové
oblasti) dosahuje kov plné pasivity a u některých pasivovatelných kovů
může
docházet ke snížení korozní rychlosti tak, že prakticky odpovídá úplné
odolnosti kovu. K přechodu kovu z aktivního do pasivního
stavu je
třeba překonat kritickou pasivační proudovou hustotu, která odpovídá
hodnotě
při dosažení Ep. Čím je její hodnota menší, tím snáze kov do
pasivního stavu přechází. U slitin se tato hodnota snižuje přísadou
dobře
pasivovatelných kovů, tj. u korozivzdorných ocelí především chrom nad
12%, dále
pak molybden a nikl. Využitelnou oblastí pasivity se vyznačují jen
některé kovy
např. chrom, hliník, titan, zirkonium a hořčík. Pasivní vrstvy těchto
kovů mají
nečastěji oxidický charakter, mohou však vznikat i vrstvy solné. Jiné
kovy jsou
pasivní jen v omezené oblasti pH. Odolnost kovu v pasivním
stavu
především závisí na rychlosti rozrušování pasivní vrstvy
v daném
prostředí a podmínkách. Při dalším růstu potenciálu a překročením
hodnoty Et
dochází ke korozi v transpasivním stavu.
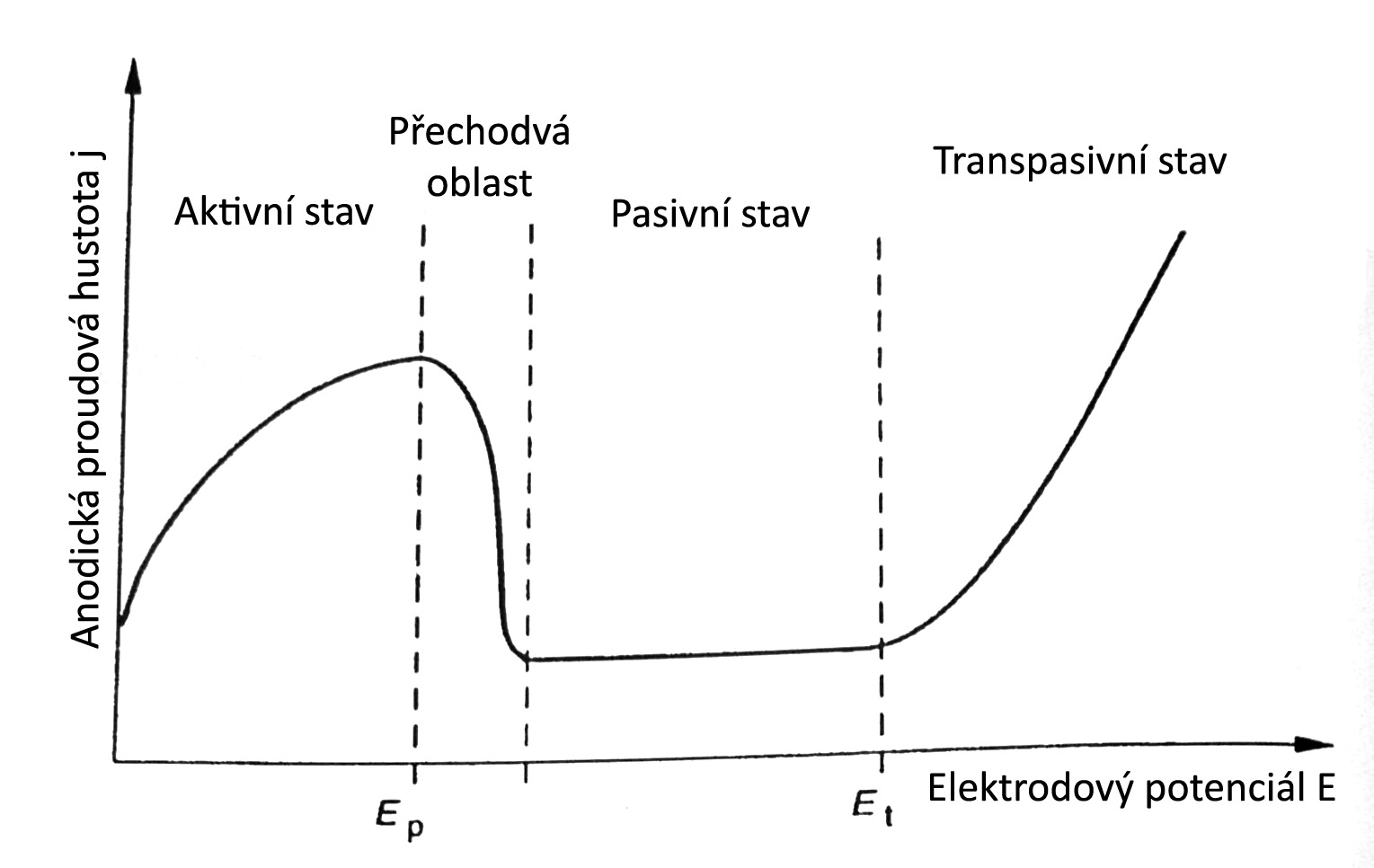
Ep = pasivační potenciál, tj. korozní potenciál, při němž hodnota korozního proudu dosahuje vrcholu a nad nímž je oblast potenciálů, kde je kov v pasivním stavu, tzn. stav kovu, u kterého dochází ke snížení korozní rychlosti vytvořenou pasivační vrstvou.
Et = transpasivační potenciál, tj. potenciál, nad nímž je kov v transpasivním stavu, tzn. stav kovu, který je polarizován na hodnotu potenciálu nad oblastí pasivního stavu a je charakterizován výrazným vzestupem korozního proudu a to bez výskytu bodové koroze.
2.5 Druhy korozního napadení
Koroze kovů se projevuje nejen hmotnostním a rozměrovým úbytkem materiálu a tvorbou korozních produktů, ale i strukturním poškozením materiálu. Korozní napadení je možné hodnotit z mnoha hledisek. Korozi, která se projevuje nezávisle na struktuře kovu nebo slitiny, dělíme podle stupně rovnoměrnosti rozpouštění povrchu, dále se používá rozdělení podle typu napadení a vzhledu materiálu, podle charakteru korozního děje a podle korozního prostředí. Je-li koroze složena za dvou dílčích dějů, pak se souhrnně jedná o korozní proces. Základní druhy koroze dle charakteristiky tvaru napadení jsou:
Rovnoměrná koroze
Rovnoměrná koroze způsobuje stejnosměrné rozpouštění po celém povrchu a lze ji vyjádřit ztrátou hmotnosti v gm-2d-1, úbytkem tloušťky v mm/rok apod. Zda došlo ke koroznímu napadení se usuzuje ze změny profilu povrchu před korozní zkouškou a po ní. Jednoznačné zjištění vyplyne ze stanovení změny hmotností a rozměrů vzorků. Schéma rovnoměrného napadení je na obr. 5.
Rovnoměrně jsou napadeny např. kovy v případech, kdy nemají ochranné vlastnosti a je celá korodovaná plocha pokryta korozními zplodinami, jestliže vznikající zplodiny nemají ochranné vlastnosti a umožňují stejnoměrnou difúzi iontů po celém fázovém rozhraní nebo vznikají rozpustné korozní zplodiny.
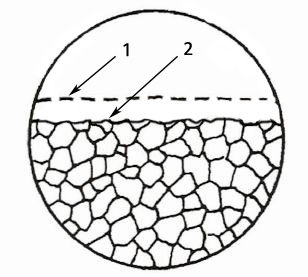
Obr. 5 Rovnoměrná koroze,
1 – původní povrch,
2 – povrch po napadení
Bodová koroze
Jedná se o zvláště nebezpečný druh napadení u materiálů odolných proti rovnoměrné korozi; při celkově malém hmotnostním úbytku materiálu může vést k rychlé perforaci do velké hloubky, která je podstatně větší než průměr bodového napadení. Schéma bodové koroze je na obr. 6.
Dochází k ní především v roztocích
obsahujících
chlor, brom nebo jod, jejich soli, zejména halogenidy těžkých kovů nebo
chlornany.
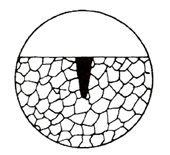
Obr. 6 Schéma bodové koroze
Důlková koroze
Podobně jako bodová se projevuje u pasivovaných materiálů lokálním porušením ochranné vrstvy za vzniku aktivního centra. Hloubka napadení se však přibližně rovná jeho šířce. Schematické znázornění důlkové koroze je na obr. 7. Příklad napadení hliníkové slitiny důlkovou korozí společně s bodovou je zobrazen na snímku ze světelného mikroskopu na obr. 8.
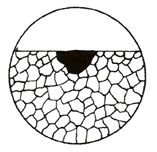
Obr. 7 Schéma důlkové koroze

Obr. 8 Napadení důlkovou a
bodovou korozí hliníkové slitiny AlCu4Mg, expozice
1000 h v solné mlze 5 % NaCl
Selektivní napadení
Selektivní koroze se vyskytuje u slitin s dvou a vícefázovou strukturou a projevuje se napadením pouze jedné fáze (obr. 9a). V případě, že korodující fáze je ve struktuře přítomna v menším množství, vzniká korozní napadení selektivní a jeho tvar je závislý na tvaru a rozložení korodující fáze. Obvykle se korodující fáze liší chemickým složením. Také může dojít k napadení pouze některých zrn jednofázové struktury (obr. 9b) nebo pásma tvořeného vměstky či precipitáty.
Příklad napadení hořčíkové slitiny AZ91 po expozici v korozní komoře v prostředí solné mlhy je zobrazen na snímku ze světelného mikroskopu na obr. 10.
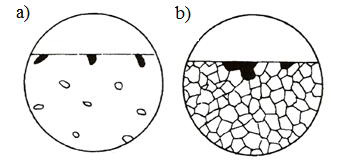
Obr. 9 Schéma selektivní koroze; a) napadena jedna fáze více
fázové struktury, b) napadení jednotlivých zrn struktury
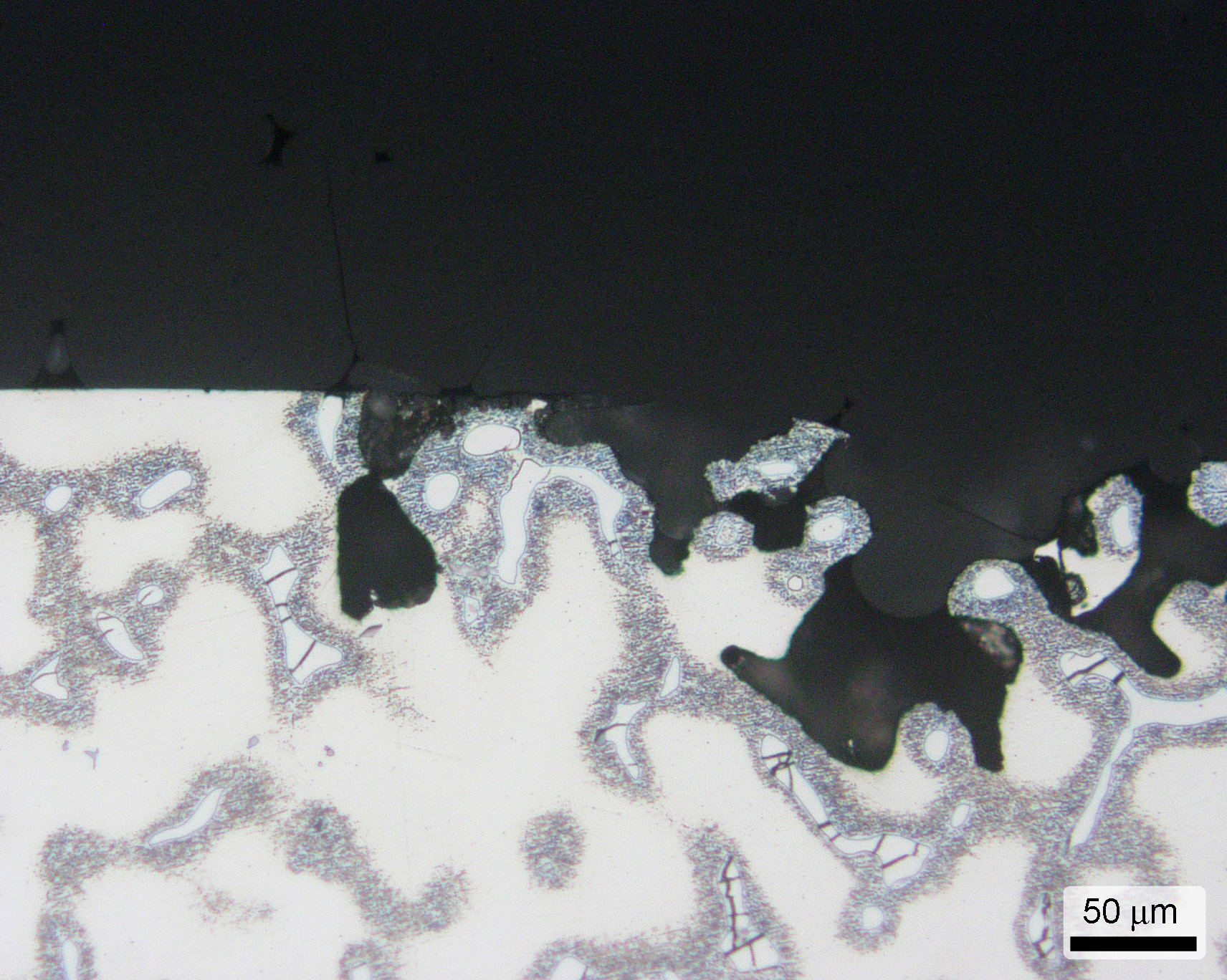
Obr. 10 Selektivní koroze hořčíkové slitiny AZ91, expozice 48 h v solné mlze 5 % NaCl
Mezikrystalová koroze
Tento typ koroze vzniká
v případě, že napadení hranic zrn
je podstatně rychlejší než koroze vlastního zrna a je doprovázena
zhoršením
mechanických vlastností.
Koroze může probíhat po hranicích
všech zrn nebo jen některých, obecně
dosud neurčitelných. Napadení může být také plošně omezeno a vytvářet
shluky
vlivem nehomogenity prostředí nebo vlivem odlišnosti vlastností hranic
zrn v
určité oblasti kovů.
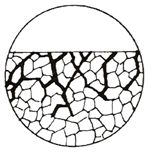
Obr. 11 Schéma mezikrystalové koroze

Obr. 12 Napadení mezikrystalovou korozí
hliníkové slitiny AlCu4Mg,
expozice 480 h v solné mlze 5 % NaCl
Korozní praskání
Korozní praskání
vzniká při současném působení koroze a
mechanických vlivů, kdy může být korozní napadení intenzivnější, než
jaké by
odpovídalo součtu poškození při odděleném působení obou vlivů. Vznik
tohoto
jevu závisí především na typu korozního prostředí, na teplotě a na
velikosti
faktoru intenzity napětí. Typická prostředí, která vyvolávají korozní
praskání
u vybraných typů slitin jsou popsána v Tab. 1.
Citlivost na korozní praskání ovlivňují:
- metalurgické faktory
- chemické složení kovu,
- velikost vnitřního napětí, stupeň deformace,
- přítomnost heterogenity,
- elektrochemické faktory
- hodnota elektrochemického potenciálu,
- schopnost kovu pasivovat se,
- charakter korozního prostředí.
Tab. 1 Typická prostředí vyvolávající korozní praskání některých slitin
|
Slitiny |
|
|
Hliníku |
Roztoky NaCl-H2O2; roztoky NaCl;
mořská voda, vzduch, pára. |
|
Mědi |
Páry a roztoky amoniaku; aminy, voda, pára. |
|
Zlata |
Roztoky FeCl3; kyselina octová, solné roztoky |
|
Olova |
Roztok octanu olovnatého |
|
Hořčíku |
Roztoky NaCl-K2CrO4, přímořská
atmosféra; destilovaná voda |
|
Niklu (Monel, Inconel, Nikl) |
Soda – roztoky, tavenina; kyselina fluorovodíková,
kyselina fluorokřemičitá |
|
Titanu |
Mořská voda; zejména kyselina dusičná; oxidy dusíku typu
NOx; methanol – HCl |
|
Ocel uhlíková |
Roztoky NaOH; roztoky NaOH-Na2SiO3;
roztoky dusičnanu vápenatého, sodného i amonného; směsi kyselin (H2SO4
a HNO3), roztoky HCN; kyselý roztok H2S, mořská
voda, amoniak. |
|
Korozivzdorné oceli |
Kyselé roztoky chloridů (MgCl2 + BaCl2);
roztoky NaCl – H202; mořská voda - H2S;
roztoky NaOH – H2S; vody za vyšších teplot a tlaků a
kondenzáty obsahující chloridy, kyslík. |
Čisté kovy mají vyšší odolnost vůči
koroznímu praskání ve srovnání
s jejich slitinami, nejsou ovšem imunní. Porušení může mít
charakter
interkrystalický, kdy se trhlina šíří po hranicích zrn nebo
transkrystalický, a to v případě, že se trhlina šíří přes zrna.
Korozní únava
Korozní únava vzniká, jestliže je materiál vystaven střídavému namáhání a součastně koroznímu prostředí. Nelze uvažovat o mezi únavy, protože korozí se průřez součástí stále zmenšuje. Únavová křivka se stoupajícím počtem cyklů stále klesá při klesajícím napětí, takže i pod mezí únavy dojde k lomu.
Korozní únavu lze vysvětlit na základě účinků vrubů vyvolaných korozí a obecně energetickými procesy na povrchu kovu za koroze. Povrchově aktivní látky ovlivňují stav napjatosti v závislosti na relativním povrchovém napětí a kapilárním vnikání do nerovností povrchu a mikrotrhlin, vznikajících v průběhu únavy. Tyto trhliny bývají obvykle transkrystalické a mohou se větvit.
Ing. Aneta Němcová, doc. Ing. Bohumil Pacal, CSc., 2010